제 10 강 중화반응
■산∙염기의 당량
1g당량: 해리될 경우에 H+ 또는 OH- 1몰을 발생시키는 산 또는 염기의 질량
1가의 산 또는 1가의 염기 1몰


■규정농도(N)
용액 1ℓ중에 포함되어 있는 산 또는 염기의 g당량
1가의 산(염기)
.1몰의 질량 = 1g당량
.몰농도 = 규정농도
n가의 산(염기)
.규정농도 =n × 몰농도
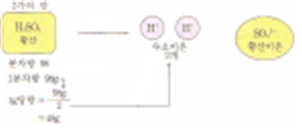
1몰(2g당량)을 물에 녹여 1L로 하면 2규정 농도가 된다.
(농도) 1몰/L = 2g당량/L = 2규정농도 용액
■중화반응
산과 염기가 반응하여 염과 물을 생성하는 반응
일반적으로 열을 발생시키며 물을 생성시키는 반응
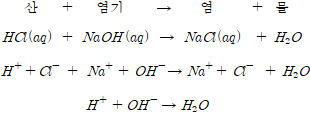
1.중화점
산(염기)과 동일한 g당량의 염기(산)을 가하여 수용액이 중성이 되는 상태
염의 가수 분해로 수용액은 산성 또는 중성이 나타나기도 함.
산의 g당량수 = 염기의 g당량수
2. 중화반응의 계산
중화반응공식

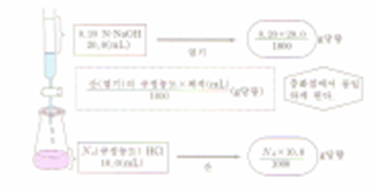
중화반응의 계산
NaOH 4.0g이 녹아있는 수용액 500㎖에서 취한 20㎖를 중화하는데 필요한 0.4N 염산 수용액은 몇 ㎖인가?

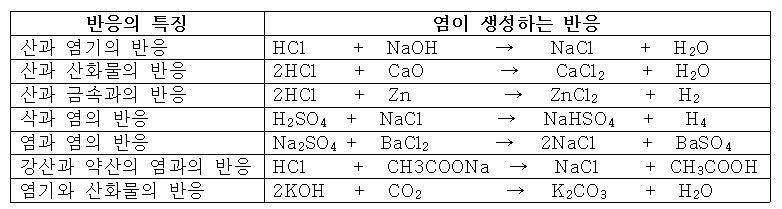
■염의 생성
⑴정염(중성염)
해리하여 H+도 OH-도 생성하지 않는 염
NaCl, CaCl2, Na2SO4...
⑵산성염(수소염)
전리하여 H+를 생성하는 염
NaHCO3, Ca(HSO4)...
⑶염기성염
해리하여 OH-를 생성하는 염
MgCl(OH), CuCl(OH)...
■중화적정
농도를 알 수 없는 일정 부피의 산(염기)을 정확한 농도를 알고 있는 염기(산)용액으로 중화시키는데 필요한 부피를 측정하여 산(염기)의 농도를 계산하는 방법
뷰렛을 사용하며 농도를 알고 있는 용액을 방울방울 떨어뜨린다.
.역적정: 과잉 적정 후 재 적정하는 방법
농도를 알 수 없는 시료인 산 (또는 염기)에 농도를 아는 염기(또는 산)를 과잉으로 적정, 시료를 중화한 후 여분의 염기(또는 산)를 농도를 아는 산(또는 염기)으로 중화적정.
1.지시약
산(염기)에 의한 중화점을 확인하기 위하여 사용하는 물질
pH에 따라서 변색하는 물질
중화반응시 생성된 염의 영향을 고려하여 적적한 시약을 선택
2.적정곡선
중화적정시 산(염기)에 적정한 염기(산)의 부피를 x축으로 각 부피에 따른 pH를 y축으로 나타낸 그래프
중화점에서 pH가 급격히 변함
* 강산과 강염기의 적정곡선
.강산과 강염기의 적정곡선에는 pH 4~10사이에서 변색하는 지시약의 사용이 가능.
.지시약은 메틸레드, 페놀프탈레인 어느쪽을 사용해도 중화점 확인 가능.
.pH는 중화점 부근에서 급격히 변한다.

* 약산과 강염기의 적정곡선

.중화점은 pH 6.5~10.5사이에 있다.
.지시약은 페놀프탈레인이 적절하다.
* 강산과 약염기의 적정곡선

.중화점은 pH 4~7에 있다.
.지시약은 메틸레드가 적절하다.
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 12. 산화와 환원 2 (2) | 2023.02.04 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 11. 산화와 환원 (1) | 2023.02.03 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 9. 전해질용액과 산・염기 2 (0) | 2023.02.01 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 8. 전해질용액과 산・염기 (0) | 2023.01.31 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 7. 기체의 성질 (1) | 2023.01.30 |



