제 9 강 전해질용액과 산∙염기 2
■질량작용의 법칙
아세트산과 에틸알코올의 반응

1. 평형 상수
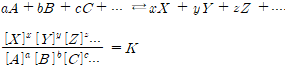
온도가 일정하면 평형상수 K값은 일정하다.
2.물의 이온적
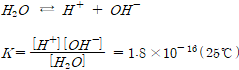
H2O의 농도 변화는 거의 없다.

■해리상수
강전해질: 수용액 중에서 완전히 해리
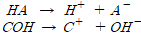
약전해질: 해리평형을 이루어 질량작용의 법칙 적용
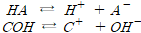
산과 염기의 전리상수(25℃)

1.해리도
해리가 되는 정도
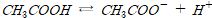

■용해도적
난용성 물질의 해리
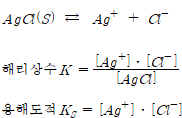
난용성 물질: 용해도가 0.1g/L이하인 물질
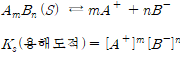
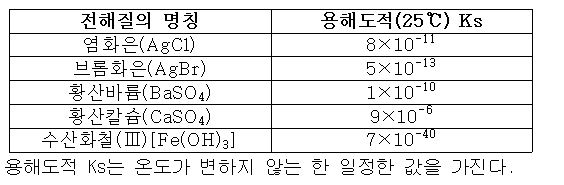
용해도적
■염의 가수분해
염: H+또는 OH-를 포함하지 않는 이온성 물질
중화반응에 의해서 생성
염의 가수분해: 염이 물과 반응하여 분해하는 현상
주요한 산과 염기의 강약
| 강산 | 약산 | 강염기 | 약염기 | ||||
| HCl | 염산 | H3PO4 | 인산 | NaOH | 수산화나트륨 | NH3 | 암모니아 |
| HNO3 | 질산 | H2C2O4 | 수산 | KOH | 수산화칼륨 | Mg(OH)2 | 수산화마그네슘 |
| H2SO4 | 황산 | H2SO3 | 아황산 | Ca(OH)2 | 수산화칼슘 | Cu(OH)2 | 수산화구리(Ⅱ) |
| H2C3 | 탄산 | Ba(OH)2 | 수산화바륨 | Al(OH)3 | 수산화알루미늄 | ||
| CH3COOH | 아세트산 | Fe(OH)3 | 수산화철(Ⅲ) | ||||
| H3BO3 | 붕산 | ||||||
| H2S | 황산수소 | ||||||
염은 강산․강염기의 영향을 받는다.
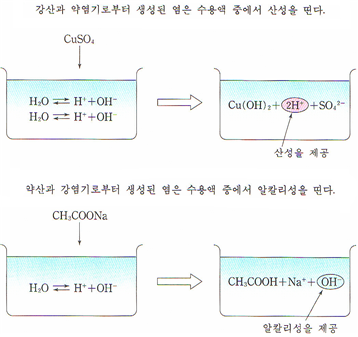
1. 산성염

염의 가수분해: 염이 물과 반응하여 분해하는 현상.
2. 염기성염

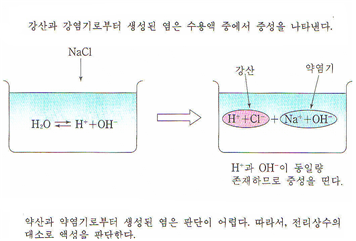
3. 중성염
강산과 강염기로부터 생성된 염은 해리된 후에도 H+ 또는 OH-와 반응하지 않는다.
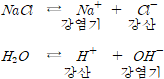
약산과 약염기로부터 생성된 염은 해리된 후 전리상수가 큰 쪽의 지배를 받는다.
.산의 해리상수가 크면 → 산성
.염기의 해리상수가 크면 → 염기성
■완충용액
소량의 산 또는 염기를 더 넣어도 pH가 크게 변하지 않는 용액
약산과 그 약산의 염이 혼합된 수용액
약염기와 그 약염기의 염이 혼합된 수용액
동물의 체액 또는 인간의 혈액
.완충용액에 산(H+)를 가하면 F-과 반응하여 HF를 생성하나 수용액 중의 H+을 증가시키지는 않는다.
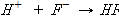
.염기(OH-)를 가하면 HF와 반응하여 물과 F-이 생성되지만 OH-의 농도를 증가시키지는 않는다.
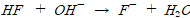
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 11. 산화와 환원 (1) | 2023.02.03 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 10. 중화반응 (3) | 2023.02.02 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 8. 전해질용액과 산・염기 (0) | 2023.01.31 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 7. 기체의 성질 (1) | 2023.01.30 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 6. 반응속도와 화학평형 (1) | 2023.01.28 |



