제 11 강 산화와 환원
■산화와 환원
1.좁은 의미의 산화
산소와 결합하는 반응을 하는 것
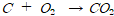
수소원자를 잃어버리는 것

2.좁은 의미의 환원
수소와 결합하는 반응을 하는 것
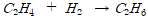
산소원자를 잃어버리는 것
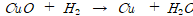
5. 넓은 의미의 산화∙환원
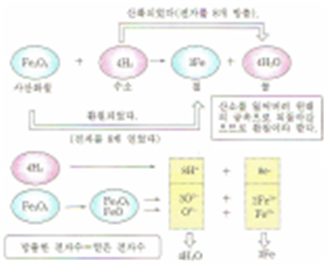
산화와 환원은 물질간의 산소(또는 수소)와 전자의 교환
환원: 분자, 원자, 이온 등이 전자(e-)를 얻을 경우
산화: 분자, 원자, 이온 등이 전자(e-)를 잃을 경우
6. 산화∙환원반응
산화반응과 환원반응은 항상 동시에 일어난다.
산화구리와 주석의 반응
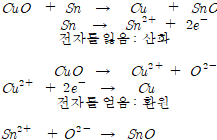
■산화수
.산화 환원 반응에서 이동한 전자의 수
.화합물 중 산화수의 총합은 항상 0
.단일 산화∙환원 반응에서 산화수 증가와 감소는 동일
.반응 전체 산화수의 총합도 불변
.이원자 분자의 각 원자 산화수는 0
1. 산화수의 결정방법
산화수의 기본은 전자의 이동.
원자가 전자 1개 방출 ⇒ 원자의 산화수 증가 ⇒ 산화
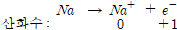
원자가전자 1개 얻음 ⇒ 원자의 산화수 감소 ⇒ 환원
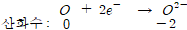
이온의 위첨자로 표시하는 전하는 산화수와 같다.
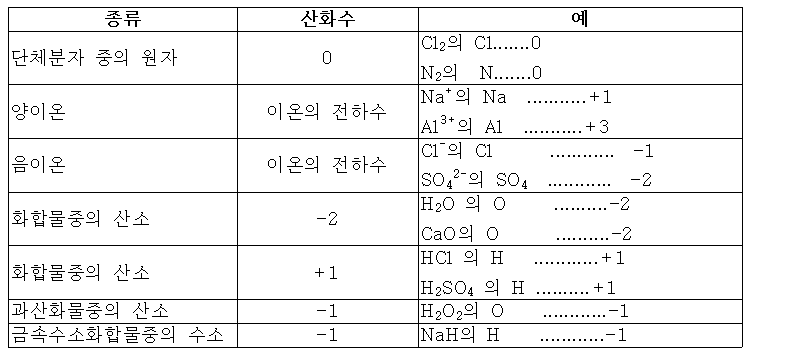
▮산화수를 정하는 규칙▮
1.모든 원자들의 산화수의 합이 화학종의 전하와 같다.
(중성분자의 경우 = 0)
2.결합되지 않은 원소화합물이 아닌 원소상태의 산화수는 0이다.
(Cl2 = 0)
3.단원자 이온의 산화수는 그 이온의 전하와 같다.
(Na+ = +1, S2- =-2)
4.화합물에서 알칼리금속 원자의 산화수는 항상 +1이다.
5.화합물에서 알칼리 토금속 원자의 산화수는 항상 +2이다.
6.화합물에서 수소의 산화수는 +1이다. 단, 금속 특히 알칼리금속, 알칼리 토금속들과 수소만의 화합물에서의 산화수는 -1이다.
(NaH, CaH2, AlBH4, LiAlH4;metal hydride)
7.화합물에서 산소의 산화수는 보통 -2이다. 단, 과산화물인 경우 -1
(H2O2, Na2O2)
8.화합물에서 할로겐 원자의 산화수는 대부분 -1이다. 그러나 산소 혹은 다른 할로겐과의 결합에서는 예외.

2.산화수의 산화∙환원
산화수의 증감을 통하여 물질의 산화와 환원을 결정
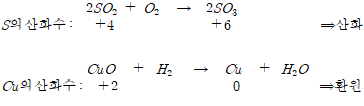
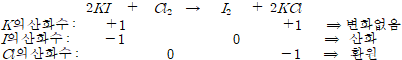
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 13. 화학실험의 기초 (0) | 2023.02.05 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 12. 산화와 환원 2 (2) | 2023.02.04 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 10. 중화반응 (3) | 2023.02.02 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 9. 전해질용액과 산・염기 2 (0) | 2023.02.01 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 8. 전해질용액과 산・염기 (0) | 2023.01.31 |



