제 8 강 전해질용액과 산・염기
■산과 염기
해리: 이온화합물, 산 또는 염기가 수용액 중에서 이온으로 분리되는 것
수용액 중에서 H+를 생성하는 물질이 산이다.
수용액 중에서 OH-를 생성하는 물질이 염기이다.
* 산: 신맛
청색리트머스지를 적색으로 변화시킴
금속을 녹여 수소를 발생시킴
* 염기: 쓴맛
적색리트머스지를 청색으로 변화시킴
미끈거림(양잿물)
1.산
수용액 중에서 수소이온(H+)를 생성시킴

2.염기
수용액 중에서 수산화이온(OH-)을 생성시킴.

3.브뢴스테드∙로리 산염기
아레니우스 산∙염기 : 수소이온 또는 수산화이온의 생성을 산∙염기 구분

브뢴스테드∙로리 산∙염기
산: 수소이온을 다른 물질에 줄 수 있는 물질
염기: 수소이온을 다른 물질로부터 받을 수 있는 물질

4.산∙염기의 가수
어떤 산 또는 염기 1몰이 수용액 중에서 완전히 해리 되어 H+ 또는 OH-를 n몰 생성시킬 때 n가의 산 또는 n가의 염기라고 한다.
| 산 | 염기 | ||||
| 1가산 | HCl | 염산 | 1가염기 | NaOH | 수산화나트륨 |
| HNO3 | 질산 | KOH | 수산화칼륨 | ||
| CH3COOH | 아세트산 | NH3 | 암모니아 | ||
| 2가산 | H2SO4 | 황산 | 2가염기 | Mg(OH)2 | 수산화마그네슘 |
| H2CO3 | 탄산 | Ca(OH)2 | 수산화칼슘 | ||
| 3가산 | H3BO3 | 붕산 | 3가염기 | Al(OH)3 | 수산화알루미늄 |
| H3PO4 | 인산 | Fe(OH)3 | 수산화철 | ||
■전리(해리)평형
해리: 이온화합물, 산 또는 염기가 수용액 중에서 이온으로 분리되는 것
전해질: 수용액 중에서 해리할 수 있는 물질
강전해질 vs. 약전해질
.강전해질; 수용액 중의 이온수가 많다.
α의 값이 크다.
강산, 강염기, 수용성염
.약전해질; 수용액 중의 이온수가 적다.
α의 값이 적다.
약산, 약염기
.이온의 해리도: 전해질이 수용액 중에서 해리된 비율

.강산∙강염기: 해리도가 1에 가까운 산∙염기
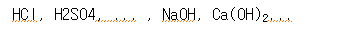
.약산∙약염기: 일부만 해리하여 산 또는 염기가 이온과 해리평형을 이룬다.
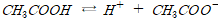
.물의 해리 평형 H2O도 해리된다.

순수한 물 1ℓ→ 55.56몰 (물의 비중 =1)
.25℃에서 10-7몰의 H+와 OH-가 존재
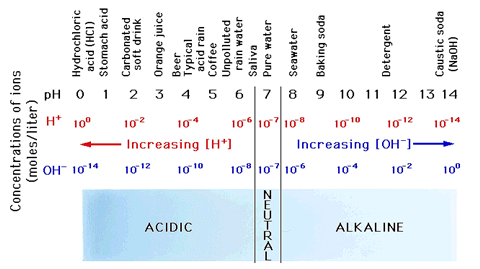
■수소이온농도
물질의 A의 몰농도:[A]
;순수한 물에 존재하는 H+와 OH-의 농도
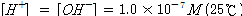
물의 이온적

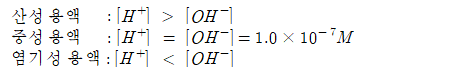
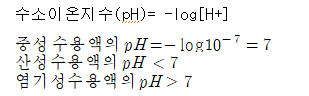
⑴HCl 0.05몰이 물 1L에 녹아있는 수용액
(염산은 수용액 중에서 완전히 해리한다고 가정)

산이 녹아 있는 용액이 중성일 수는 없다.
⑶HCl 10-7몰 수용액에 존재하는 수소이온
HCl이 매우 묽을 경우에는 물의 해리에 의한 수소이온농도도 고려.
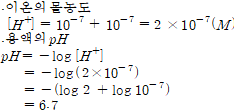
⑷0.01M 아세트산 수용액(해리도 0.013)의 pH
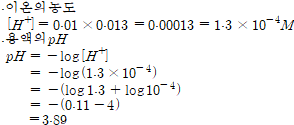
* pH가 1증가 할 때 수소이온농도는 10배 감소한다.
* pH가 1감소 할 때 수소이온농도는 10배 증가한다.
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 10. 중화반응 (3) | 2023.02.02 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 9. 전해질용액과 산・염기 2 (0) | 2023.02.01 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 7. 기체의 성질 (1) | 2023.01.30 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 6. 반응속도와 화학평형 (1) | 2023.01.28 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 5. 용해 (0) | 2023.01.27 |



