12. 산화와 환원 2
■산화제와 환원제
1.정의
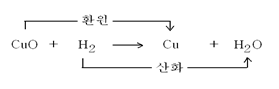
* 산화제: 산화환원반응에서 자신은 환원되며 다른 물질을 산화시키는 물질
산화수가 감소
* 환원제: 산화환원반응에서 자신은 산화되며 다른 물질을 환원시키는 물질
산화수가 증가
2. SO2의 산화∙환원
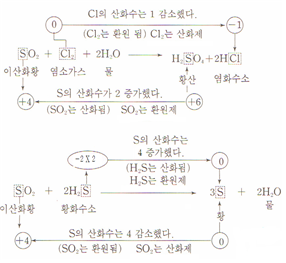
3. 주요 산화∙환원제의 반응기구

5. 산화∙환원 적정
중화적정과 같은 원리
같은 당량을 사용하여 당량점 결정

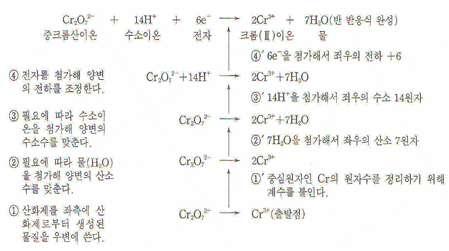
6.산화∙환원의 반 반응식
중크롬산칼륨K2Cr2O7(산화제)의 반 반응식
■금속의 이온화 경향
금속
.전자를 방출하여 양이온이 되려는 성질 → 산화
.환원력이 강한 금속도 있음
.이온화 경향의 차이 → 산화∙환원 반응
1. 이온화 경향: 금속이 전자를 방출하여 양이온이 되려고 하는 성질

2.표준전극전위

.이온화경향: 정성적 순서(실제의 크기나 차이 등은 알 수 없다.)
.금속의 이온화 경향을 정량적으로 비교할 수 있는 기준이 필요
.단극전위: 실온에서 1M의 금속용액에 그 금속을 담그었을 때 발생되는 전위차 → 측정할 수 없음
.수소전극을 기준으로 설정한 후 전지를 구성
수소보다 환원이 잘되면 표준전극전위 = + 값
수소보다 환원이 안되면 표준전극전위 = - 값
3.표준 환원전위
: 표준 수소 전극과 환원이 일어나는 반쪽 전지를 결합시켜 만든 전지에서 측정한 전위
1. 모든 반쪽 반응은 환원되는 형태로 나타낸다.
2. 각 반쪽 반응은 오른쪽으로 진행할 수도 있고 왼쪽으로도 진행할 수 있다.
3. 표준 환원 전위의 값이 클수록 환원이 잘 되고 그 값이 작을수록 산화가 잘 된다.
4. 산화제는 반쪽 반응식의 왼쪽에, 환원제는 오른쪽에 나타난다.
5. 두 반쪽 전지를 연결하여 전지를 꾸밀 때, 표준 환원 전위값이 작은 것이 (-)극, 그 값이 큰 것이 (+)극이 된다.
6. 두 반쪽 전지를 연결하여 전지를 꾸밀 때, 표준 환원 전위 값 차이가 클수록 전지의 기전력이 커진다.
7. 전지의 기전력은 전지를 구성한 반쪽 전지를 구성하는 물질의 본질과 농도에만 의존할 뿐 양에는 관계없다.

4.전지
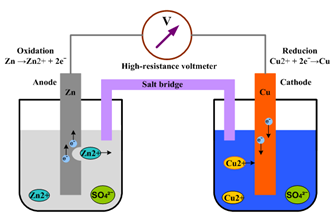
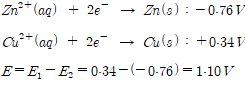
아연이 구리보다 전자를 내어놓는 세기가 1.10V만큼 크기를 갖는다는 의미
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 14. 흡광분석 (0) | 2023.02.07 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 13. 화학실험의 기초 (0) | 2023.02.05 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 11. 산화와 환원 (1) | 2023.02.03 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 10. 중화반응 (3) | 2023.02.02 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 9. 전해질용액과 산・염기 2 (0) | 2023.02.01 |



