제 5 강 용해
■물질의 태
물질이 존재할 수 있는 세 가지 상태: 고체, 액체, 기체
* 고체 : 물질을 구상하는 입자들이 규칙적으로 배열되어 일정한 위치에 고정
(입자간 거리 매우 짧음) 운동에너지는 없으나 진동에너지는 있음
* 액체: 입자의 자유로운 운동이 가능, 분자 간 인력이 상대적으로 커 입자간 거리는 짧음
* 기체: 액체에 비하여 입자의 운동이 더 활발하며 분자 간 인력이 매우 약화되어 입자의 운동이 매우 자유로움
1.물질의 3태
.상평형도표

* 물질의 상태는 온도와 압력의 변화에 따라 달라진다.
융점(녹는점): 고체가 액체로 변할 때의 온도
응고점(어는점): 액체가 고체로 별할 때의 온도
비점(끓는점): 액체가 기체로 변할 때의 온도
■용해
.용해: 어떠한 물질이 액체에 균일하게 혼합된(녹아있는) 상태
.용매: 물질을 용해시키는 액체
.용질: 용매에 녹아 있는 물질, 용질은 고체, 액체, 기체의 상태 중 하나이다.
.용액: 용질과 용매의 균일한 혼합물
1.극성분자와 비극성분자
.용질이 모든 용매에 용해되는 것은 아니다.
:기름은 물과 섞이지 않지만, 에탄올은 물과 잘 섞임
.물의 분자구조: 수소와 산소의 공유결합
두 O-H 결합은 일정한 각(104.5°)을 이룸, 공유전자쌍이 산소쪽에 치우침
→산소의 큰 전기음성도로 인하여 부분전하 형성
→극성분자
.전기음성도: 공유결합을 하고 있는 분자 내의 원자가 전자를 잡아당기는 힘

.극성분자: 두 원자간의 공유전자쌍의 전자가 한 원자쪽으로 치우쳐 있는 분자
→ H2O, HCl, C2H5OH ... 결합하고 있는 두 원자 (혹은 작용기) 사이의 전기 음성도 차이가 크게 나며 비대칭 구조임.
.비극성분자: 한 분자내의 (+)전하의 중심과 (-)전희의 중심이 일치하여 분자 내에 부분 전하를 띠지 않는 분자,

2. 염화나트륨의 용해
.염화나트륨: 염소이온과 나트륨이온이 이온결합에 의해 규칙적 배열을 이룬 결정
물에 녹으면 Cl은 Cl-로, Na는 Na+로 이온화
.수화: Cl-과 Na+는 극성을 띤 물 분자에 의해 둘러싸이게 된다.
.모든 이온성 물질이 수화되지는 않는다.

3.에틸알콜의 용해
.에틸알콜의 분자구조: 에틸알콜은 수산화기(-OH)를 함유한 극성 분자이다.
수산화기는 물의 경우와 같이 공유전자쌍이 산소쪽으로 치우쳐있다.
대칭구조를 갖는 벤젠이나 에틸에테르는 물에 녹지 않는다.
■용해평형과 용해도
용질이 용매에 용해되는 양은 한정되어 있다.
온도에 따라 용해될 수 있는 용질의 최대량은 변화한다.
용해평형 포화 용액: 설탕을 물에 녹이면 일정량까지는 용해가 되지만 어느 순간부터 더 이상 녹지 않고 가라앉는다.
용해도: 설탕물의 온도를 높이면 설탕을 더 녹일 수 있다.
1.용해평형
용해평형: 단위 시간당 녹는 이온의 수와 재결정 이온의 수가 같아지는 상태
포화용액: 용해평형이 된 후 그 이상 녹는 이온의 수가 늘어나지 않는 상태가 된 용액
용해도: 특정한 용매에 대하여 용질이 더 이상 녹지 않고 용해평형이 이루어지는 한도
→온도에 따라 용해도는 변함.
2.고체와 기체의 용해도
소금 또는 설탕은 물의 온도가 높을수록 더 많이 녹는다.
. 고체의 용해도: 일반적으로 고체의 수용성물질은 고온에서 입자의 운동에너지가 증가하여 용매에 용해가 더 잘된다.
. 기체의 용해도: 일반적으로 고온에서 입자의 운동에너지가 증가하여 용매로부터 이탈하기 쉬워진다. →기체는 온도가 높아지면 용해도가 감소하는 경향
헨리의 법칙
일정한 온도에서 일정량의 액체에 녹는 기체의 질량은 용매에 접해있는 기체의 압력(분압)에 비례한다. →기체의 압력과 녹는 용질의 양은 정비례
4.용액의 농도
용액에 용해될 수 있는 최대한의 정도: 용해도
정량적 표시를 위하여 정량적인 단위가 필요
-중량백분율
-몰농도
-중량몰농도
1.중량백분율(중량 퍼센트, 퍼센트농도)
용액 100g중에 녹아있는 용질의 질량을 그램수로 나타낸 % 단위의 농도

ex) NaCl 30g을 물 70g에 녹인 용액의 중량백분율
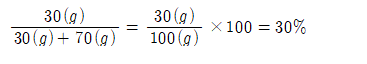
HCl 1몰(㏖)의 물 10몰(㏖)에 녹인 용액의 중량백분률
HCl 1㏖: 36.5g
H2O 10㏖: 180g
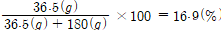
2.몰농도
.몰농도: 용액 1ℓ중에 녹아 있는 용질량을 몰(㏖)수로 나타낸 농도단위(㏖/ℓ 또는 M)

ex)35g을 물 100㎖에 녹인 용액의 몰농도를 구하시오.
NaCl의 몰농도 계산:

3.중량몰농도
.중량몰농도: 용매 1kg중에 녹아있는 용질량을 몰(㏖)수로 나타낸 농도단위 (㏖/kg)
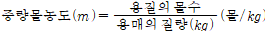
묽은 용액의 끓는점 상승, 어는점 강하 등을 고려할 때 사용
ex)NaCl 35g을 물 70g에 녹인 용액의 중량몰농도
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 7. 기체의 성질 (1) | 2023.01.30 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 6. 반응속도와 화학평형 (1) | 2023.01.28 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 4. 화학의 기본법칙과 반응식 (1) | 2023.01.26 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 3. 화학량과 화학결합 (0) | 2023.01.26 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 2. 주기율표와 화학식 (1) | 2023.01.25 |



