제 3 강 화학량과 화학결합
■화학에서 사용하는 여러 가지 양
모든 원자와 분자는 고유한 질량을 가지고 있음.
물질의 양을 표현하는 단위는 질량, 부피가 대표적.
.화학량: 반응과 관계하는 물질의 양
원자량, 분자량, 화학식량, 아보가드로수, 몰, 당량, 그램당량 등...
1.원자량과 분자량
.수소원자의 질량: 양성자 1개 + 전자 1개
→

.원자량: 탄소원자 1개의 질량을 12.0으로 정의한 후 , 각 원자의 상대적 질량을 결정 → 단위가 없음
.분자량: 분자를 구성하고 있는 원자의 종류와 숫자에 각각의 원자량을 합한 값
설탕(C12H22O11)의 분자량 : 12.0*12 + 1.0*22 + 16.0*11 = 342
.화학식량: 분자의 형태를 취하지 않는 물질에 대하여, 조성식량을 사용 → 원자량의 합
염화나트륨(NaCl)의 조성식량 : 23.0 + 35.5 =58.5
2.원자가․당량
.원자가: 원자가 다른 원자와 결합하는 능력을 정수로 나타냄 →결합손의 수를 표시
H:1가, O: 2가, N: 3가, C: 4가, P:5가
.당량: 원자량을 원자가로 나눈 값

수소원자 결합하는 원자들의 질량 → 그램당량 H:1.0, O:8.0, N:4.67, C:3.0, P:6.2
3.아보가드로수와 몰
.아보가드로수: 어떤 원소 시료의 질량이 그램단위로 표시되어 있고 그 값이 원소의 원자질량과 같을 때 그 시료가 함유하고 있는 원자의 개수.

.몰(㏖): 입자들이 아보가드로수만큼 모여 있는 양
입자는 원자/분자/이온/전자 등이 될 수 있다.
.이온의 질량: 전자의 무게는 원자핵의 무게에 비하여 매우 작아 원자의 무게와 거의 같음.
4.각 화학식량의 관계
.원자 또는 분자 등의 입자 1몰의 질량은 원자량 또는 분자량에 g을 붙인 질량과 같음
① 원자 6.02× 1023개의 질량 = 원자 1몰의 질량 = (원자량)g
*원자량 자체는 단위가 없지만 그 수치에 g을 붙인 질량
② 분자 6.02× 1023개의 질량 = 분자 1몰의 질량 = (분자량)g
*분자량 자체는 단위가 없지만 그 수치에 g을 붙인 질량
③ 입자 6.02× 1023개의 질량 = 그 입자 1몰의 질량 = (조성식량)g
■화학결합
.분자는 원자들의 화학결합으로 이루어진다.
1.이온결합
.양이온과 음이온이 정전기력으로 서로 당겨 결합하는 것
금속(metal) + 비금속(nonmetal) → 전자 이동 (electron transfer)
비방향성(non-directional) 결합
IE 값이 낮은 원자: 양이온 (1, 2족)
EA 값이 큰 음수인 원자: 음이온(16, 17족)
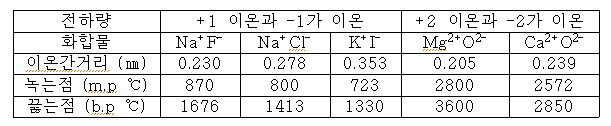
.이온결정: 양이온의 이웃에 음이온이, 그 이웃에 양이온이 나열되어 입체적으로 질서 정연하게 배열 → 이온성 물질
.이온성 물질은 결정구조를 갖는다.
.NaCl: Na+와 Cl-의 면심입방격자가 조합
.이온결합에 강도의 차이가 있다.
정전기력: 이온간 거리의 제곱에 반비례

2.공유결합
.두 원자간에 가전자를 서로 공유함으로써 결합하는 것
.원자사이의 전기음성도 차이가 0이거나 아주 작을 때 주로 형성
비금속 원소(nonmetal) + 비금속 원소(nonmetal)
ex)H + Cl, H + F, H + O
탄소 화합물
ex)C + H, C + Cl
비금속의 단체
ex)H2, O2, N2, Cl2
.두 원자간에 작용하는 에너지가 최소값이 되는 핵간 거리 → 공유결합거리
.분자: 원자가 공유결합에 의하여 새로이 생성된 입자
.분자내 모든 원자는 불활성기체의 전자배치를 하고 있음
.공유전자쌍: 공유결합에 관여하는 전자쌍
.비공유전자쌍: 공유결합에 관여하지 않는 전자쌍
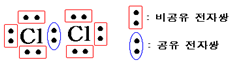
.다중결합: 여러 쌍의 공유전자쌍으로 공유 결합한 것
단일결합, 이중결합, 삼중결합
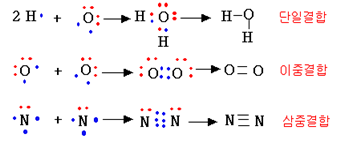
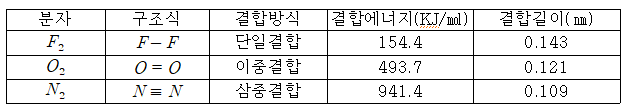
.다중 결합 특성
①결합력 :다중 결합일수록 결합력(=결합에너지)이 커진다.
단일 결합 < 이중 결합 < 삼중 결합
②결합 길이 :다중 결합일수록 결합 길이가 짧아진다. 결합 을 이루는 두 원자핵들 사이의 거리가 짧을수록 강한 결합이다.
3.금속결합 : 금속 원자가 원자가전자를 내놓고 양이온으로 되어 안정하게 되고, 원자로부터 떨어져 나온 원자가전자가 자유 전자가 되어 양이온 사이에 고르게 공유되어 있는 상태.
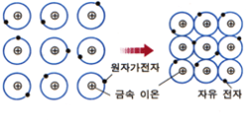
.구성원자가 규칙적이며 입체적인 배열을 한 것
.결정구조를 이루고 있음
.최외각 전자궤도의 중첩
.각 원자의 가전자가 중복된 전자궤도를 자유로이 이동
→자유전자(free electron):금속의 양이온 사이를 자유롭게 돌아다니면서 서로 반발하는 양이온을 정전기적인 인력으로 결합시켜주는 전자.
.금속을 구성하고 있는 모든 원자가 전자를 공유
.양이온과 양이온 사이에 자유전자를 공유
.원소기호만으로 금속을 나타냄(합금제외)
Fe(철), Cu(구리), Au(금), Ag(은), Al(알루미늄), Pb(납)
.전성: 금속에 힘을 가하면 넓게 퍼지는 성질
.연성: 금속을 잡아 당길 경우 길게 늘어나는 성질
.전도성: 자유전자의 이동에 의하여 전기가 잘 통한다.
.결합력의 세기 :
4.수소결합
.수소결합: 분자 내의 수소가 주변 분자의 불소, 산소, 질소 등과 약한 결합을 형성하는 것 수소 결합력은 분산력이나 이중 극자 사이의 힘 보다 훨씬 강함.
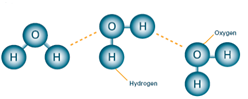
.같은 계열의 다른 화합물보다 m.p 및 b.p 몰증발열이 훨씬 높음.
. 수소결합은 분자간의 힘(분산력)보다 크고 공유결합력 보다는 작음.

. 물의 끓는점이 상대적으로 높은 이유
. 생체 내 단백질의 입체구조
.DNA의 이중 나선구조
5.배위결합
.배위결합: 공유결합의 일종으로서 결합하고 있는 두 원자 중 한 원자가 전자쌍을 모두 제공하는 것
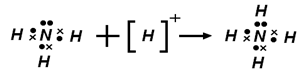
.금속의 착화합물을 생성시킴
.착이온 : 중심금속 + 배위자(Ligand)
.중심 금속 :주로 전이원소의 금속
.배위자(ligand) :비공유 전자쌍 있는 분자나 이온
ex) H2O, NH3, CN-, Cl-, 등
.결합 형식: 중심 금속과 배위자가 배위 결합
.배위수(배위자의 수): 2, 4, 6등 중심 금속에 대칭이 될 수 있는 수
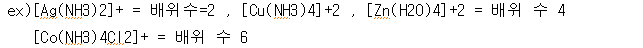
.착이온의 입체구조 : 착 이온의 구조는 배위수에 의해 결정됨
배위수 = 2 ▶ 직선형 배위수 = 4 ▶ 평면사각형. 정사면체형 배위수 = 6 ▶ 정팔면체
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 6. 반응속도와 화학평형 (1) | 2023.01.28 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 5. 용해 (0) | 2023.01.27 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 4. 화학의 기본법칙과 반응식 (1) | 2023.01.26 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 2. 주기율표와 화학식 (1) | 2023.01.25 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 1. 화학의 기초 (0) | 2023.01.25 |



