제 1 강 화학의 기초
1.지수 사용법

2.단위 및 기호
국제 표준 단위계(International System of Unit, SI Unit)

■물질
.물체와 물질: 사물을 판단하는 기준의 차이
형태/크기 vs. 구성성분
.물질의 세가지 형태
| 형태 | 분자사이의 거리 | 분자배열 | 모양 | 부피 |
| 고체 | 가깝다 | 규칙적 | 일정하다. | 작다. |
| 액체 | 비교적 가깝다 | 불규칙적 | 일정하지 않다. | 작다. |
| 기체 | 매우 멀다 | 매우 불규칙적 | 일정하지 않다. | 매우 크다. |
.상평형: 일정 온도 및 압력 하에서 고체, 액체, 기체가 평형을 이루어 공존하고 있는 상태
.상평형도표: 한 물질의 기체, 액체, 고체들 사이의 평형을 온도 변화에 따른 증기 압력의 변화로 나타낸 그림. 물질의 상태변화를 나타냄. 물리변화를 나타내며 화학변화에 대한 정보는 없음.
T: 삼중점(고체, 액체, 기체가 공존)
1.물질의 변화

.물리변화: 물질의 상태가 변화
융해와 응고(고체 ↔ 액체)
액화와 기화(액체 ↔ 기체)
승화(고체 ↔ 기체)
.화학변화: 한가지 물질이 전혀 다른 새로운 물질로 변화
화학반응이 일어나는 경우
ex) 납 + 요오드 → 요오드화납
2.물질의 종류와 구성
.순물질: 완전히 한 종류의 물질로 된 것
고정된 조성과 일정한 성질을 갖는다.
ex) 산소, 소금, 물, 황산 등
.혼합물: 여러 종류의 물질이 섞여 있는 것
각각의 물질이 그 자체가 갖고 있는 화학적 성질을 유지
ex) 공기, 식염수, 주스, 술, 합금, 화장품 등
| 물 질 |
혼합물 | 불균일혼합물 | 소변, 연무 |
| 균일혼합물 | 공기, 식염수, 합금 | ||
| 순물질 | 단체 | 산소, 탄소, 황, 금, 은, 알루미늄 (성분원소 1종류) | |
| 화합물 | 물, 이산화탄소, 염화나트륨, 황산, 산화칼슘, 수산화나트륨 (성분원소 2종류 이상) |
■원자
.원소(element): 물질을 구성하는 성분 혹은 요소
.원자(atom): 원소의 실체가 되는 입자
.돌턴의 원자설:1808년 화학 철학의 새 체계
① 물질은 각각의 원자들로 이루어진다.
② 한 물질에 포함된 모든 원자는 질량이 동일하고, 모든 성질이 같다.
③ 서로 다른 물질은 각각 다른 원자들로 구성되며 특히, 각각의 원자는 그 질량이 다르다.
④ 원자는 더 이상 쪼갤 수 없으며, 화학 반응 후에도 그 성질이 변하지 않는다.(질량 보존의 법칙)
⑤ 화합물은 서로 다른 원자들이 일정한 정수비를 이루며 결합하여 생성된다.
1.원소기호: 원자를 입자로 표시하는데 쓰이는 알파벳
일반적으로 대문자 한 개 혹은 대문자 한 개와 소문자 한 개로 구성
ex) H: 수소, He: 헬륨, F: 불소, Fe: 철
최근 발견된 원자 중 대문자 한 개와 소문자 두 개로 명명된 경 있음
ex) Uuq: 유넌쿼디움, Uup: 유넌펜티움
.원자번호: 원자의 핵에 포함된 양성자의 수를 사용
2. 원자의 구성
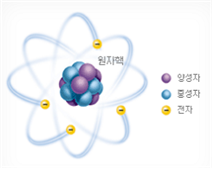
-원자는 원자핵(nucleus)과 전자(electron)로 이루어진 입자.
-원자핵은 양성자(proton)와 중성자(neutron)로 구성.

3.원자번호(atomic Number)
: 어떤 특정한 원소의 원자는 핵 안에 모두 똑같은 개수의 양성자를 가지는 수, 원소의 기본 성질을 정함.
. 중성 원자에 존재하는 양성자의 수와 전자의 수는 항상 동일
양성자의 수 = 전자의 수
.전자의 수는 가변적
→ 이온화 및 화학결합에 의한 전자의 궤도이탈
원자번호 = 양성자의 수
| 원자번호 | 원자기호 | 영어명(IUPAC)+ | 한국명 | 원자번호 | 원자기호 | 영어명(IUPAC)+ | 한국명 |
| 1 | H | Hydrogen | 수소 | 27 | Co | Cobalt | 코발트 |
| 2 | He | Helium | 헬륨 | 28 | Ni | Nickel | 닉켈 |
| 3 | Li | Lithium | 리튬 | 29 | Cu | Copper | 구리(동) |
| 4 | Be | Berylium | 베릴륨 | 30 | Zn | Zinc | 아연 |
| 5 | B | Boron | 붕소 | 33 | As | Arsenic | 비소 |
| 6 | C | Carbon | 탄소 | 35 | Br | Bromine | 브롬 |
| 7 | N | Nitron | 질소 | 36 | Kr | Krypton | 크립톤 |
| 8 | O | Oxygen | 산소 | 38 | Sr | Strontium | 스트론튬 |
| 9 | F | Fluorine | 불소(플루오르) | 47 | Ag | Siver | 은 |
| 10 | Ne | Neon | 네온 | 48 | Cd | Cadmium | 카드뮴 |
| 11 | Na | Sodium | 나트륨 | 50 | Sn | Tin | 주석 |
| 12 | Mg | Magnesium | 마그네슘 | 51 | Sb | Antimony | 안티몬 |
| 13 | Al | Aluminium | 알루미늄 | 53 | I | Iodine | 요오드 |
| 14 | Si | Silicon | 규소 | 54 | Xe | Xenon | 크세논 |
| 15 | P | Phosphorus | 인 | 56 | Ba | Barium | 바륨 |
| 16 | S | Sulfur | 황 | 78 | Pt | Platinum | 백금 |
| 17 | Cl | chlorine | 염소 | 79 | Au | Gold | 금 |
| 18 | Ar | Argon | 아르곤 | 80 | Hg | Mercury | 수은 |
| 19 | K | Potassium | 칼륨 | 82 | Pb | Lead | 납 |
| 20 | Ca | Calcium | 칼슘 | 83 | Bi | Bismuth | 비스무트 |
| 24 | Cr | Chromium | 크롬 | 86 | Rn | Radon | 라돈 |
| 25 | Mn | Manganese | 망간 | 88 | Ra | Radium | 라듐 |
| 26 | Fe | Iron | 철 |
.동위체(동위원소): 같은 종류의 원자 중, 원자핵 내에 존재하는 중성자의 수가 다른 경우
화학적 성질은 변하지 않으나 질량의 차이가 있음.
.질량수(mass number): 양성자와 중성자의 무게를 1로 가정한 후, 각각을 더한 값
질량수= 양성자의 수 + 중성자의 수
ex)산소 (O)의 질량수
중성자수 8개 → 8+8 =16 중성자수 9개 → 8+9 =17 중성자수 10개 → 8+10 =18
* 수소 (H)의 질량수
중성자수 0개 → 1+0 = 1 중성자수 1개 → 1+1 = 2 (중수소, deuterium)
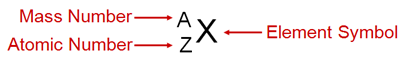
4.전자배치
.전자는 원자핵 주위의 궤도를 따라 고속으로 돌고 있음
.전자각(전자 궤도): 전자가 돌고 있는 원자핵 주위의 궤도, 여러 가지 궤도가 존재
원자핵으로부터 가까운 순으로 K각, L각, M각, N각 등으로 명명함
각 전자궤도에는 수용할 수 있는 전자의 수가 주양자수에 따라 한정되어 있음
.주양자수(Principal Quantum Number): 원자 또는 분자를 양자역학적으로 해석할 때에 에너지와 각운동량 등과 같은 성질이 연속적이지 못하고 분절되는 현상이 발견되어, 이 현상을 수학적으로 표현할 때 사용되는 수. n값이 커질수록 궤도함수는 커짐.
| 주양자수(n) | 1 | 2 | 3 | 4 | 5 | ... |
| 전자각명(Shell) | K | L | M | N | O | ... |
| 최대수용 전자수(2n2) | 2 | 8 | 18 | 32 | 50 | ... |
.원자핵에 가까운 전자궤도의 에너지 준위가 상대적으로 낮음
-에너지 준위: 양자역학적으로 계산되는 에너지의 단계
.주양자수의 값이 작은 궤도부터 전자가 채워짐
.정전기력: 양전하를 가진 양성자와 음전하를 가진 전자가 서로 당기는 힘
양전하와 음전하 사이의 거리가 멀어질수록 정전기력은 약하여짐
.최외각: 전자가 존재하는 전자궤도 중 핵으로부터 가장 멀리 떨어져 있는 궤도
최외각에 존재하는 전자는 영향을 받는 정전기력이 상대적으로 약함
.가전자: 최외각에 존재하는 가전자 산소의 가전자는 L각, 염소의 가전자는 M각에 위치
'환경화학' 카테고리의 다른 글
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 6. 반응속도와 화학평형 (1) | 2023.01.28 |
|---|---|
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 5. 용해 (0) | 2023.01.27 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 4. 화학의 기본법칙과 반응식 (1) | 2023.01.26 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 3. 화학량과 화학결합 (0) | 2023.01.26 |
| 화학과, 화학공학, 취업깡패 등 방통대 환경화학 요점 정리 2. 주기율표와 화학식 (1) | 2023.01.25 |



