제6장 단백질과 그 대사작용
1.단백질의 특성
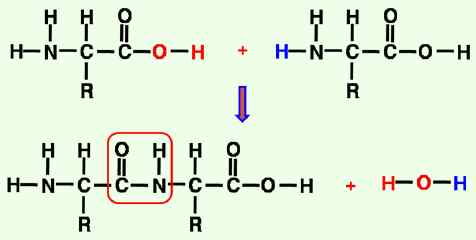
-탄소, 수소, 산소, 질소 및 황으로 구성.
-아미노산이 펩타이드 결합6)으로 연결된 고분자 화합물.
-펩타이드 결합은 carboxyl group의 C=O와 amine group의 N이 결합되어
아미노산이 연결되는 결합.
-가수분해 되어 아미노산 생성.
-산과 염기가 결합된 상태로 생리적인 상태에서는 carboxyl기와 amine기가 이온화 됨.
-생명체의 기본 구성물질 : 세포, 효소, 호르몬, 면역체.
-유기용매, 산, 염 등에 의해 응고(변성, denaturation)7).
·단백질의 중요성
-세포의 구성성분. -생명체의 기본물질. -효소의 주성분.
-영양소 운반체. -영양 및 저장 단백질. -항체의 주성분.
-세포의 활성이나 생리작용을 조절. -펩타이드 호르몬의 구성성분. -축산물의 필수 구성분.
2.단백질의 구조
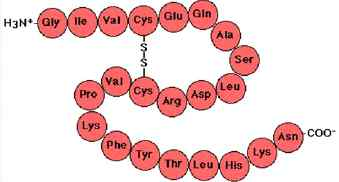
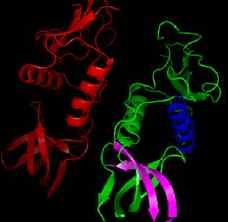
·1차 구조(Primary Structure)
-1° structure, 아미노산의 서열, 하나의 아미노산은 3개의 RNA나 DNA 정보→코돈, 단백질의 유전정보 및 특징 분석.
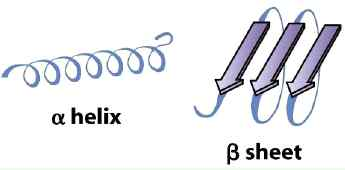
·2차 구조(Secondary Structure)
-2° structure, 탄소골격의 배치, α-helix(나선형)와 β-sheet(판형).
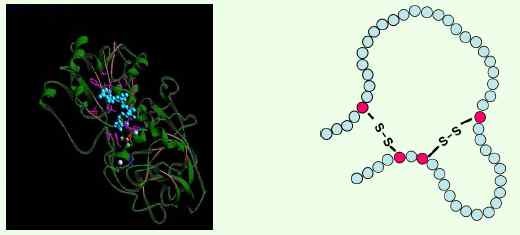
·3차 구조(Tertiary Structure)
-3° structure, 단백질의 입체구조(3차원적 구조), 단백질의 기능에 영향.
·4차 구조(Quaternary Structure)
-4° structure, Subunit(기능성 잔기) 간의 배치.
| 6) 펩타이드 결합 : 단백질을 구성하는 아미노산과 아미노산의 결합 형태로 앞의 아미노산의 카르복실기와 뒤의 아미노산의 아미노기 와의 결합. 7) 변성 : 산, 염기, 열, 자외선, 아세톤 등으로 인하여 단백질의 황이나 산의 이중결합이 풀어짐으로써 3차원의 단백질이 선형으로 변화되는 현상으로 물리적 및 생물학적 성질에도 변화가 온다. 변성이 일어나면 더욱 소화효소의 공격을 받기 쉽다. |
3.아미노산
(1)아미노산의 특성
-수용성이며 공유결합 화합물.
-탄소수가 적은 지방산의 유도체.
-산과 염기가 결합된 양성 물질.
-고유의 등전위점(Isoelectric point, pI)8).
(2)아미노산의 종류
①앨리패틱 아미노산…-NH2와 COOH의 수에 따라 분류.
·모노아미노-모노카르복실 아미노산(아미노기 1개+카르복실기 1개)
-글리신9), 알라닌10), 발린, 류신, 이소류신, 세린, 트레오닌.
·모노아미노-디카르복실 아미노산(아미노기 1개+카르복실기 2개)
-아스파르트산, 글루탐산.
·디아미노-모노카르복실 아미노산(아미노기 2개+카르복실기 1개)
-리신
·트리아미노-모노카르복실 아미노산(아미노기 3개+카르복실기 1개)
-아르기닌.
·함황 아미노산
-시스틴, 메티오닌11), 시스테인.
②방향족 아미노산…벤젠고리가 함유된 아미노산.
-페닐알리닌, 티로신.
③이상환상 아미노산…부정형의 고리가 함유된 아미노산.
-트립토판, 프롤린, 히스티딘.
(3)필수아미노산
-정의 : 체내에서 합성되지 않거나, 합성되어도 그 양이 부족하여 사료의 형태로 반드시 공급되어야 하는 아미노산.
-이유 : 체내에서 탄소골격이 합성되지 않기 때문에 아미노기 전환과정을 통하여 아미노산이 합성되지 않기 때문.
-종류 : 아르기닌, 히스티딘, 이소루신, 루신, 리신, 메티오닌, 페닐알라닌, 트레오닌, 트립토판, 발린.
-준필수아미노산 : 기능상 특정 아미노산을 대치하거나 합성할 수 있는 것(페닐알리닌→티로신, 메티오닌→시스틴).
4.단백질의 종류와 특징
(1)단백질의 종류
①단순단백질
-아미노산만으로 구성된 단백질.
-구형단백질과 선형단백질로 구분.
·구형단백질(구상, 공모양)
-Polypeptide chain이 구형을 형성, 기능성 단백질의 주성분(효소, 호르몬, 항체 등).
-알부민 : 수용성, 열에 쉽게 응고됨, 혈액, 젖, 알에 존재.
-히스톤 : 세포의 핵에 존재, 염용액에 용해되나 열에 응고 안됨, 알지닌과 라이신으로 가수분해 됨.
-프로타민 : 척추동물의 정자의 주성분, 핵산과 결합하여 존재.
-글로불린 : 젖, 난, 혈액에 존재하는 저장성 단백질.
·선형단백질
-동물의 체내에서 구조적 기능 수행, 소화효소에 의해 쉽게 분해되지 않음.
-콜라겐 : 동물의 결체조직(연결부위)의 주성분.
| 8) 등전위점 : 단백질의 전하가 0이 되는 pH로 단백질의 아미노산 조성에 의해 달라짐. 9) 글리신 : 가장 간단한 아미노산으로, 아미노 아세트산이라고도 한다. 10) 알라닌 : 피루브산을 통해 TCA 회로에서 에너지 생성에 이용될 수 있다. 11) 메티오닌 : 단백질의 합성에 첫 번째로 이용되는 필수아미노산, 단백질 합성의 개시코돈. |
-엘라스틴 : 건(떡심, tendon), 혈관과 같이 신축성이 있는 조직의 주성분.
-케라틴 : α-케라틴(털, 모발), β-케라틴(깃, 피부, 부리, 각질)…UDP(반추위 비분해단백질) 함량이 가장 높음.
②복합단백질
-아미노산과 비단백질성 물질로 구성된 단백질.
·당단백질
-점막의 형태로 분비되어 윤활작용을 수행, 난백의 저장성 단백질.
-종류 : 글루코사민, 갈락토사민.
·지방단백질
-세포막의 주요 성분.
-혈액의 지방이 세포 내로 유입되는 형태.
·인단백질
-인산기를 함유하는 단백질.
-카세인, 난황의 포스비틴.
·색소단백질
-단백질과 세포가 결합한 형태.
-헤모글로빈(산소의 운반), 시토크롬(전자 전달).
③기타
·유도단백질
-1차 유도체 : 변성단백질.
-2차 유도체 : 단백질 가수분해 산물.
·핵산
-유전정보의 저자.
-피리미딘 계열 : 시토신, 티민, 우라실.
-퓨린 계열 : 아데닌, 구아닌.
(2)단백질의 기능
-세포의 구성성분. -항체의 주성분. -효소 및 호르몬의 구성성분.
-유전현상에 관여. -물질의 운반. -영양소의 저장기능.
5.에너지 대사
(1)에너지
①에너지의 개념
-물리적인 일을 할 수 있은 힘, 생명유지 및 생산활동에 필요, 사료의 형태로 공급.
②에너지의 단위
-칼로리(Calorie, cal) : 1g의 물을 14~15℃로 올리는 데 필요한 열량.
-주울(Joul, J) : 1kg의 물체를 1m/sec²×1m 움직일 때 필요한 일의 양.
-1cal=4.184J(1J=0.239cal)
③에너지와 ATP
-ATP : 고에너지 인산화합물(아데노신에 인산기가 3개 결합되어 있는 화합물)로, 가수분해되어 인산기 1개가 유리되면
서 mol 당 7.3kcal의 에너지가 발생, 생체 내에서 에너지를 보관 및 이동하는데 이용(유사물질 : GTP, UTP, CTP).
④ATP의 이용
-체온 유지(기계적 조절, 화학적 조절), 물질의 합성, 근육의 수축, 세포막을 통한 물질의 능동수송.
·물질의 능동수송
-Na-K pump.
-신경물질의 전달과정(신경자극 전달).
-타액, 소화액, 췌장액의 분비.
-미토콘드리아 내의 Ca⁺², Mn⁺², Mg⁺² 및 인 등의 이온 이동·축적.
-소장 및 신장에서 포도당(글루코오스)과 아미노산의 흡수.
(2)에너지 생산
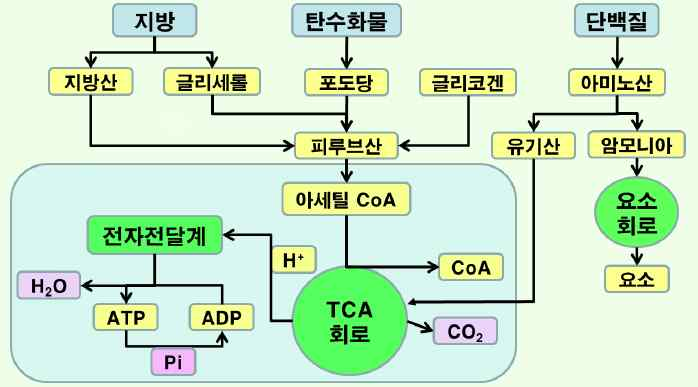
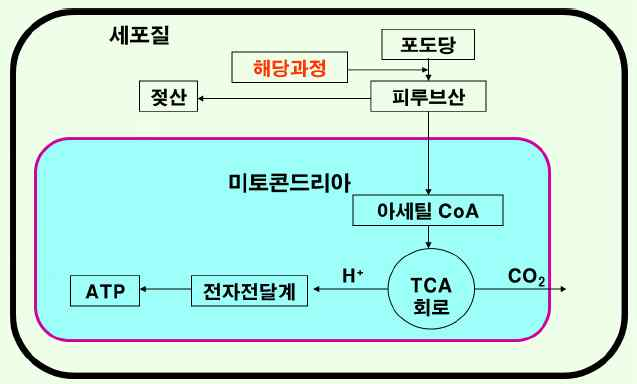
-해당과정 : 글루코오스 또는 근육 속에 들어 있는 글리코겐이 피루브산이나 젖산으로 분해되는 반응으로, 이 회로를 엠
덴-마이어호프회로(EMP)라고도 함.
-피루브산의 산화 : 피루브산이 산화되어 아세틸 CoA를 생성.
-아세틸 CoA 생성 : Coenzyme A의 노기에 아세트산이 축합(티아민이 필요함).
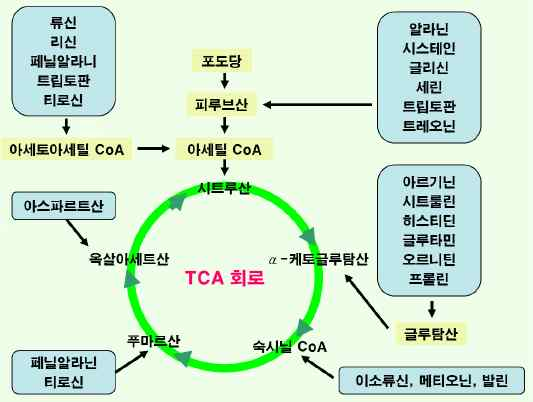
-TCA 회로 : 생체 내에서 에너지 획득을 위한 가장 효율적인 산화과정으로 호기적 조건으로 이루어짐.
-산화적 인산화 : 인산기를 두 개 가진 ADP에 인산 한 분자를 더 결합시켜 ATP를 만드는 반응. 세포가 이용할 수 있
는 형태의 고에너지 화합물인 ATP가 생성.
③지방산의 산화
·β-산화
-지방산은 산화 시 카르복시기(-COOH)로부터 베타 위치에 있는 탄소들이 2개씩 산화·분리된다. 이를 β-산화라고 함.
-β-산화는 미토콘드리아에서 이루어짐.
·α-산화와 ω-산화 : 지방산의 산화는 주로 β-산화에 의하여 이루어지나, α-산화와 ω-산화에 의해서도 이루어짐.
④휘발성지방산의 대사(반추동물)
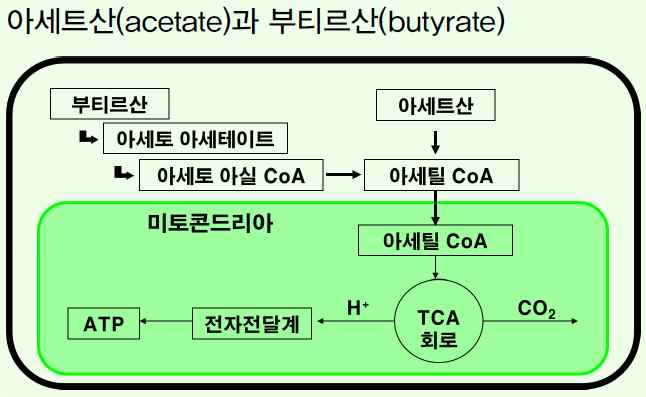
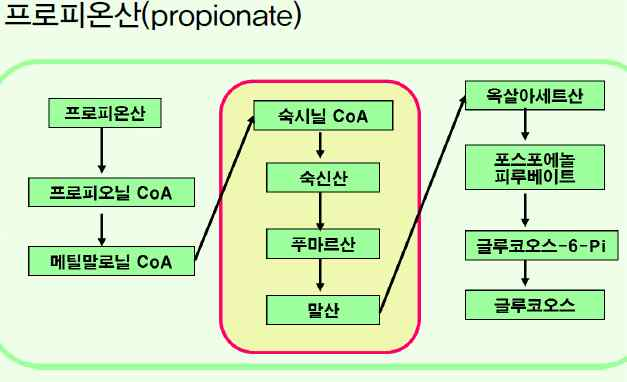
⑤아미노산의 분해
(3)탄수화물과 지방의 합성
·포도당의 신합성…동물 체내에 필요한 글루코오스를 탄수화물로부터 공급받지 못하는 경우 다른 유기물로 만듦.
-주로 신장과 간에서 이루어짐.
-글리세롤, 젖산, 프로피온산을 이용하여 합성.
-해당과정과 TCA 회로의 가역반응.
-피루브산이 말산으로 전환되어 미토콘드리아 통과.
-피루브산→옥살아세트산→말산→옥살아세트산→PEP(포스트에놀피루브산)→글루코오스.
·포도당의 필요성
-신경계통과 적혈구의 에너지원. -지방조직의 합성. -TCA 회로 유지.
-혐기상태의 근육 에너지. -유방에서 유당 합성. -임신 중 태아의 에너지원.
·지방대사의 조절인자
-구연산(citrate) : 아세틸CoA 카르복실라제 촉진.
-아실 CoA : 아세틸CoA 카르복실라제 억제.
-아실 CoA-S-에스테르 : 지방산 합성 억제.
-인슐린 부족 : 지방합성 억제.
-갑상선 호르몬, 글루코코르티코이드 : 지방 동원 증가.
·지방 합성의 구성요건
-원만한 탄수화물 대사→에너지 공급.
-NADPH가 충분히 공급되어야 함.
-아세틸 CoA의 중성지방으로 전환이 빨라야 함.
-호르몬 분비가 적절히 이루어져야 함.
-스트레스는 지방산의 대사를 증가시킴.
(4)단백질의 대사
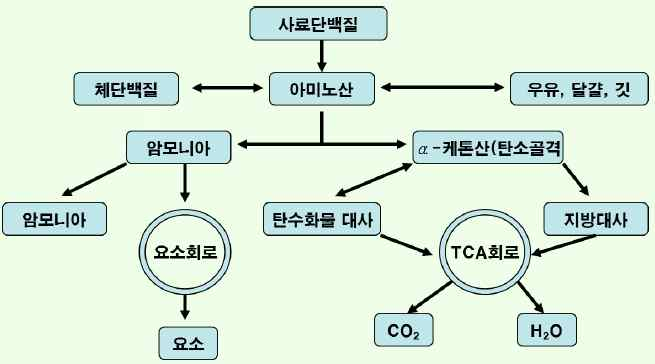
·사료단백질의 대사
-섭취된 아미노산은 체내에서 단백질 합성에 이용.
-암모니아는 요소회로를 통해 배설.
-탄소골격은 에너지 혹은 지방 합성에 이용.
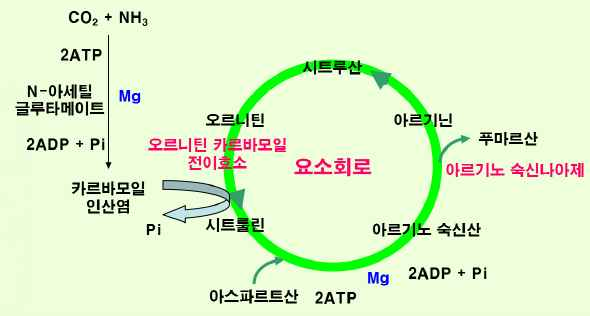
·요소회로
-아미노산의 분해로 생성된 암모니아(NH3⁺)는 대부분 요소로 합성되어 배설되거나 TCA 회로의 여러 중간 대사물로부터
비필수아미노산 합성에 이용됨.
-암모니아 체순환에 따른 중독작용을 방지하기 위하여 글루타민과 아스파라긴 같은 물질은 NH3 운반체로 쓰이기도 함.
(5)단백질의 합성
-단백질의 합성에는 유전자가 관여.
-RNA는 핵에서 합성.
-단백질은 세포질(리보솜)에서 합성.
-전사(transcription) : DNA→RNA.
-번역(translation) : RNA→단백질(아미노산 활성화→개시복합체(메티오닌) 형성→폴리펩티드 사슬 연장→단백질 합성 종결)
※ 부족하지만 글의 내용이 도움이 조금이라도 되셨다면, 단 1초만 부탁드려도 될까요? 로그인이 필요없는 하트♥(공감) 눌러서 블로그 운영에 힘을 부탁드립니다. 그럼 오늘도 행복한 하루 되십시오^^
'가축영양학' 카테고리의 다른 글
| 축산직, 농업직, 농학과 등 가축영양학 요점 요약 정리 8. 광물질과 그 대사작용 (0) | 2022.06.10 |
|---|---|
| 축산직, 농업직, 농학과 등 가축영양학 요점 요약 정리 7. 비타민과 그 대사작용 (0) | 2022.06.09 |
| 축산직, 농업직, 농학과 등 가축영양학 요점 요약 정리 5. 지방과 그 대사작용 (0) | 2022.06.08 |
| 축산직, 농업직, 농학과 등 가축영양학 요점 요약 정리 4. 탄수화물과 그 대사작용 (0) | 2022.06.07 |
| 축산직, 농업직, 농학과 등 가축영양학 요점 요약 정리 3. 물과 그 대사작용 (0) | 2022.06.06 |



